

| News Links Veranstaltungen Anreise Kontakt | |
VaskulitidenforschungÜberblickZusammensetzung der Arbeitsgruppe Kooperationspartner Aktuelle Publikationen Die Arbeiten unserer Gruppe befassen sich mit klinischen und experimentellen Aspekten von ANCA-assoziierten Vaskulititden. Uns steht ein gut definiertes Kollektiv von Patienten mit ANCA-positiven Vaskulitiden und Glomerulonephritiden zur Verfügung. Diese Patienten werden in unserer nephrologischen Klinik sowie in der angeschlossenen Ambulanz der Franz-Volhardt Klinik betreut (Links zur Klinik und Ambulanz). Um die zugrundeliegende Krankheitsmechanismen besser zu verstehen, führen wir darüberhinaus experimentelle Studien durch. Patienten mit ANCA-assoziierten Erkrankungen: 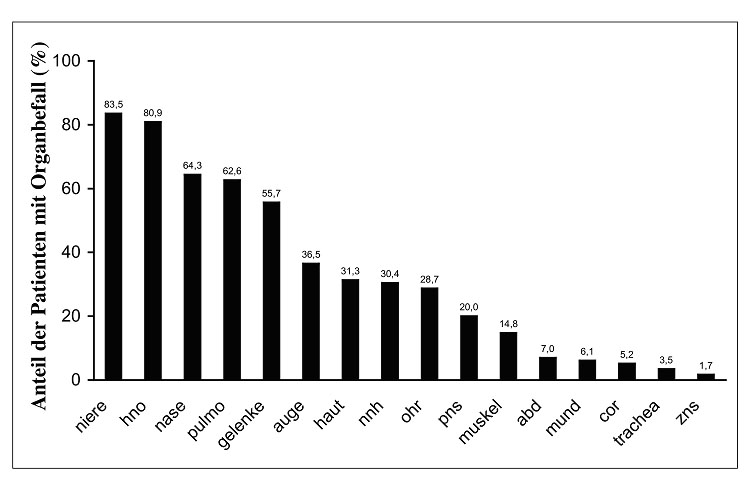 Abbildung 1: Organbefall der Wegener-Patienten unserer Abteilung ANCA-assoziierte Vaskulitiden � Hintergrund der Forschung: 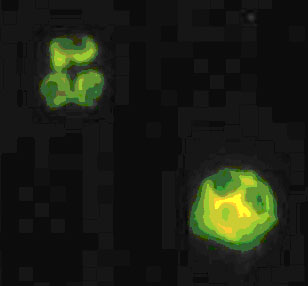 Abbildung 2: typisches p-ANCA (oben) und c-ANCA Muster (unten) ANCA stellen einen ausgezeichneten Parameter für die Diagnostik der Wegenerschen Granulomatose dar und zeigen eine recht gute Korrelation mit der Krankheitsaktivität. Darüberhinaus zeigen eine Reihe experimenteller Untersuchungen, dass der Interaktion von ANCA mit Granulozyten und Monozyten pathogenetische Bedeutung besitzt. Der endgültige Beweis für die pathogenetische Bedeutung der ANCA, konnte kürzlich in einem in vivo Mausmodell erbracht werden. Das Kernstück in den pathophysiologischen Vorstellungen ANCA-assoziierter systemischer Vaskulitiden bildet die Interaktion zwischen ANCA, den ANCA-Antigene-exprimierenden Leukozyten (neutrophile Granulozyten und Monozyten) sowie dem Endothel. Die schweren vaskulären Läsionen bei ANCA-Vaskulitiden sind durch infiltrierende neutrophile Granulozyten und Monozyten sowie durch fibrinoide Gefäßwandnekrosen gekennzeichnet Eine schematische Zusammenfassung von Einzelbefunden, die von verschiedenen Arbeitsgruppen zusammengetragen wurden, stellt sich folgendermaßen dar: 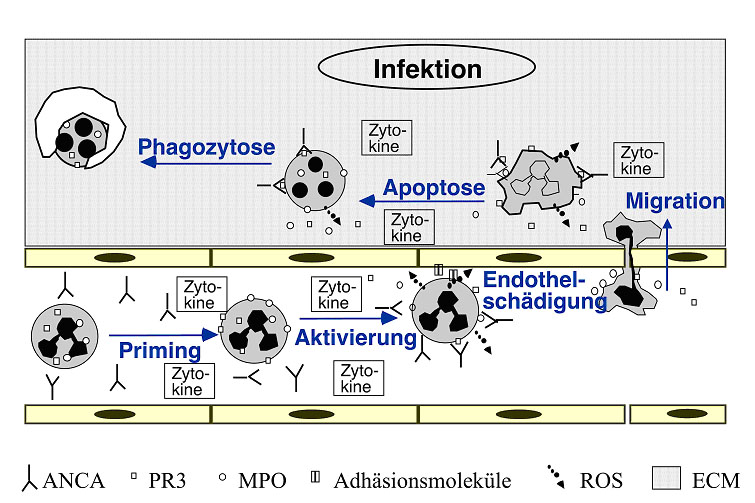 Abbildung 3: Schematische Darstellung zellulärer Mechanismen der ANCA Vaskulitis  In unserer Arbeitsgruppe werden verschiedene Krankheitsaspekte von ANCA-Vaskulitiden untersucht. Hier ein kurzer
Überblik zu derzeit aktuellen Projekten: 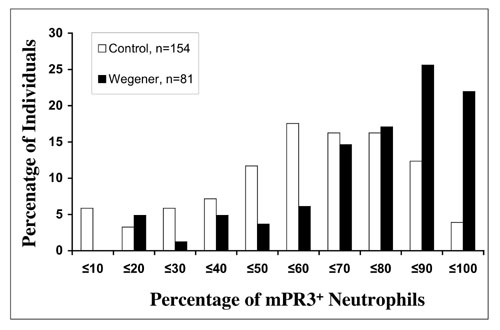 Abbildung 4: Prozentsatz von PR3-positiven Granulozyten. Vergleich von Wegener Patienten und gesunden Kontrollen Die derzeitigen Fragen befassen sich mit den Mechanismen, die die Population Membran-PR3 positiver Granulozyten bestimmen. Wir verfolgen derzeit die intrazelluläre und die Membranexpression von Proteinase 3 in Stammzellen, die zu Granulozyten differenziert werden. Wir untersuchen darüberhinaus Spender und Empfänger von Knochenmarktransplantationen bezüglich ihrer PR3 Expression. Letztlich korrelieren wir die klinischen Daten unserer Wegener-Patienten hinsichtlich des PR3-Expressionsmusters. Projekt: Regulation der Apoptose neutrophiler Granulozyten Verschieden Untersuchungen die Bedeutung der Apoptose bei Autoimmunerkrankungen demonstriert. Die Beziehung dieser beiden Faktoren ist äußerst vielfältig. Somit sind Untersuchungen zur Regulation der Apoptose von neutrophilen Granulozyten vor dem Hintergrund des für die ANCA-Vaskulitiden charakteristischen Millieus von außerordentlichem Interesse. Dabei gilt es, sowohl den Einfluß von Zytokinen, der extrazellulären Matrix als auch den Effekt von ANCA auf die Apoptose zu erfassen. So konnten wir in früheren Untersuchungen zeigen, dass die Apoptose ein weiterer Mechanismus ist, der zur verstärkten Expression von ANCA Antigenen (PR3 und MPO) ist. Dies führt in der Folge dazu, daß ANCA verstärkt an die apoptotischen Granulozyten binden. Diese verstärkte Bindung resultiert glücklicherweise nicht in eine akzelerierte Aktivierung der Zellen. Die ANCA-induzierte Granulozytenaktivierung wird also durch Apoptose herabreguliert. In aktuellen Projekten beschäftigen wir uns mit der Signaltransduktion, die die Granulozytenapoptose reguliert. Übrigens hat die durch Apoptose hervorgerufene Präsentation von ANCA-Antigenen auch negative Effekte. In Tierexperimenten führte die intravenöse Applikation apoptotischer humaner Granulozyten die Bildung von Antikörpern gegen PR3 und MPO. Die Gabe von nichtapoptotischen Kontrollzellen blieb dahingegen ohne Effekt. Zukünftige Untersuchungen sind notwendig, um die Bedeutung der Apoptose bei ANCA-Vaskulitiden genauer zu charakterisieren.   Abbildungen 5 und 6: Nicht-apoptotischer Granulozyt (links) und apoptotische Granulozyten (rechts) nach DAPI Färbung. Wir verwenden Proteintransduktionsdomänen, um spezifische Peptide in die Granulozyten einzuschleusen und Schlüsselschritte der Signaltransduktion zu blockieren. Die nachfolgende Abbildung zeigt, wie eine solche Proteintransduktionsdomäne, hier eine HIV-Sequenz fluoreszierende FITC-Moleküle in die Granulozyten schleust. Im Gegensatz dazu, können FITC-Moleküle alleine nicht nach intrazellulär gelangen. 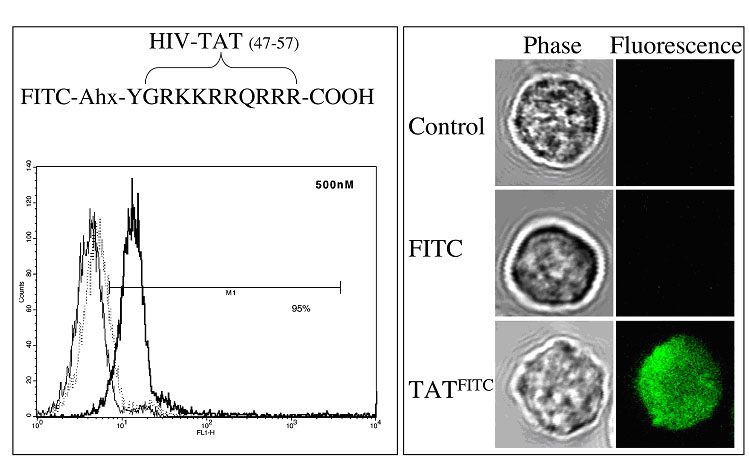 Abbildung 7: Transduktion einer TAT-Proteintransduktionsdomäne in neutrophile Granulozyten. Durchflußzytometrie (links) und
konfokale Mikroskopie (rechts). Gegenwärtige Projekte befassen sich mit der Rolle von NF-kB bei der Regulation der Apoptose und mit der Rolle von Integrinen als kostimulatorische Moleküle bei der Aktivierung von NF-kB.  Projekt: Die Rolle von Fieber bei der Aktivierung und der Apoptose von neutrophilen Granulozyten Lokale und systemische Entzündungen sind von Temperaturerhöhungen begleitet. Darüberhinaus wird die Temperaturerhöhung in der Form der Hyperthermie zur adjuvanten Therapie bei Malignomen eingesetzt. Hierbei werden systemische Temperaturen bis 42oC und lokale Temperaturen bis 43oC erzielt. Neutrophile Granulozyten sind als erste Zellen an den Orten der Inflammation. Sie sind somit nicht nur bei Fieber, sondern auch bei lokalen entzündlichen Prozessen hohen Temperaturen ausgesetzt. Erstaunlich wenige Untersuchungen beschäftigen sich mit der Auswirkung von kurzzeitigen Fieber-ähnlichen Spikes auf Granulozyten. In mehreren aktuellen Projekten beschäftigen wir uns mit der Auswirkung einer kurzzeitigen Exposition der neutrophilen Granulozyten zu steigenden Temperaturen von 37oC bis 42oC. Hierbei untersuchen wir die Effekte auf die Aktivierung von intrazellulären Signaltransduktionswegen und auf verschiedene zelluläre Funktionen, wie die Adhäsion, die Generation von Sauerstoffradikalen, und die Apoptose. In der Abbildung ist der inhibitorische Effekt einer kurzzeitigen Exposition der Granulozyten zu steigenden Temperaturen auf die durch TNF-a verzögerte Apoptose gezeigt. 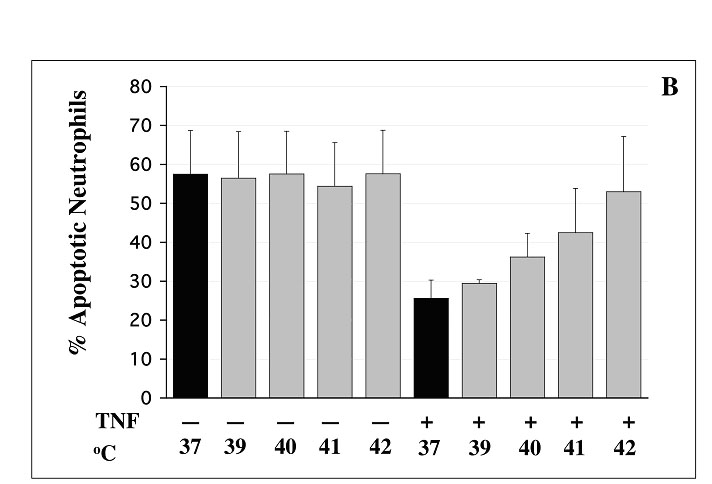 Abbildung 8: Eine kurzzeitige Exposition von Granulozyten zu steigenden Temperaturen inhibiert die Verzögerung der Apoptose durch TNF-a. Diese Untersuchungen zur Signaltransduktion und zu stimulierten Funktionen werden sich auch auf ANCA erstrecken. Dazu untersuchen wir den Effekt von Fieber auf das Zytokin-vermittelte Priming und auf die nachfolgende ANCA-vermittelten Aktivierungsprozesse. 
Gegenwärtige Zusammensetzung der Arbeitsgruppe Kooperationspartner Aktuelle Publikationen: 
|